Salah satu yang paling dibincangkan-mengenai bahan pemakanan semulajadi dalam beberapa tahun kebelakangan ini, keselamatan ashwagandha adalah kebimbangan utama bagi kedua-dua pengguna dan formulators. Untuk menentukan had penggunaan yang selamat, institusi-institusi yang berkaitan menjalankan penilaian keselamatan berlapis-lapis ashwagandha di teras komponen dan ekstrak-meliputi segala-galanya dari cytotoxicity kepada pendedahan haiwan jangka panjang. Berikut adalah penemuan utama dan kesimpulan daripada ujian ini.

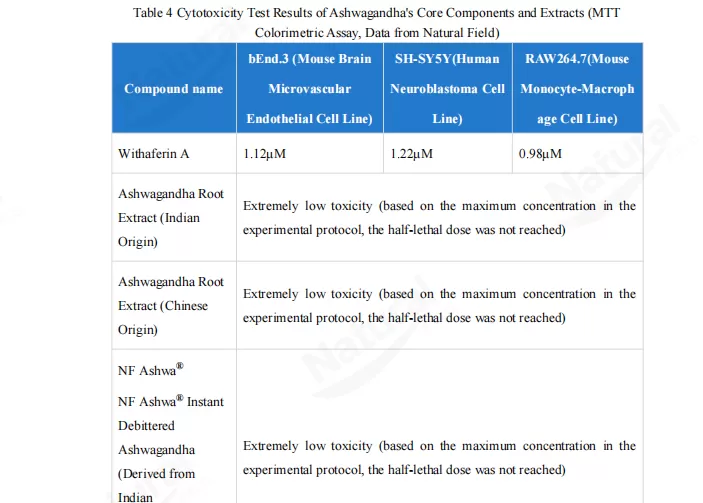
Ujian sitotoksisiti In vitro adalah langkah asas dalam penilaian keselamatan bahan mentah. Untuk kajian ini, assay MTT digunakan untuk menguji sebatian aktif terpencil ashwagandha (withaferin A) dan tiga ekstrak (ekstrak akar ashwagandha india, ekstrak akar ashwagandha cina, dan NF Ashwa™Larut air de bittered ashwagandha) merentasi 3 wakil sel garisan (meniru persekitaran sel endothelial, saraf dan imun vaskular):
Withaferin A menunjukkan beberapa ketoksikan merentasi semua tiga sel garisan, dengan kepekatan pembantut setengah maksima (IC50) antara 0.98 hingga 1.22μM.
Sebaliknya, semua tiga ekstrak ashwagandha (dari kawasan yang berbeza dan bentuk yang diproses) mempamerkan "ketoksikan yang sangat rendah" dalam julat kepekatan yang diuji-mereka tidak mencapai dos separuh-maut walaupun pada tahap yang diuji tertinggi.
Hasil ini menjadikannya jelas: ekstrak ashwagandha jauh lebih selamat untuk kegunaan selular daripada sebatian aktif terpencil, jadi memilih ekstrak adalah pilihan yang lebih dipercayai dalam aplikasi praktikal.
Untuk mengesahkan lagi dalam keselamatan vivo, pasukan penyelidikan diikuti organisasi untuk kerjasama ekonomi dan pembangunan (OECD) garis panduan untuk menjalankan satu siri ujian haiwan-meliputi genotoxicity, akut/subacute/subchronic ketoksikan dan ketoksikan pembiakan/pembangunan:
Genotoxicity: tiada risiko Mutagenic
Tiga ujian standard disahkan keselamatan genetik ashwagandha:
Assay mutasi terbalik bakteria: tiada peningkatan dalam koloni revertant pada dos 0.156-5.00 mg/plat.
Kromosom aberration cerakin: tiada kerosakan chromosomal pada kepekatan 0.25-2.00 mg/ml.
Dalam vivo micronucleus assay: tiada peningkatan dalam frekuensi sel micronucleated (MNCE) atau ketoksikan sumsum tulang pada tikus pada dos 500-2000 mg/kg.
Kesimpulan: Ashwagandha menunjukkan tiada genotoxicity dalam julat diuji.
Ketoksikan lisan akut: risiko rendah, toleransi yang tinggi
Menggunakan tikus Wistar wanita sebagai model, ashwagandha diberikan secara lisan pada dos 500, 1000, dan 2000 mg/kg berat badan, dengan 15 hari pemerhatian:
Tiada kematian haiwan, penyakit, atau tanda-tanda klinikal yang tidak normal diperhatikan. Berat badan meningkat biasanya, dan tiada patologi organ dijumpai semasa pembedahan.
Tamat tempoh dos maut median (LD50) melebihi 5000 mg/kg berat badan. Setiap klasifikasi GHS, ini jatuh ke dalam kategori 5 atau tidak dapat dikelaskan-bermakna terdapat tiada risiko ketoksikan lisan akut.
Ketoksikan Subacute/Subchronic: selamat untuk kegunaan jangka panjang
Subacute (28 hari): tikus Wistar (30 lelaki/30 wanita) menerima dos lisan harian 200-800 mg/kg berat badan ashwagandha root extract. Keputusan: semua kumpulan mempunyai kenaikan berat badan biasa dan pengambilan makanan; Penanda hematologi dan biokimia yang tinggal dalam julat normal (hanya ketinggian kecil dalam beberapa penanda dalam kumpulan dos tinggi, yang masih memenuhi piawaian industri). Penanda kembali normal dalam kumpulan satelit (diperhatikan selama 43 hari).
Subchronic (90 hari): tikus SD menerima dos lisan harian sebanyak 100-1000 mg/kg berat badan ashwagandha. Keputusan: tiada gejala toksik atau kematian; Pengambilan berat/makanan dipadankan kumpulan kawalan; Hematologi, biokimia, berat organ dan histopathology menunjukkan tiada keabnormalan. Tahap kesan buruk yang tidak diperhatikan (NOAEL) adalah 1000 mg/kg berat badan.
Ketoksikan pembiakan & pembangunan: tiada kesan ke atas pembiakan
Berikutan garis panduan OECD, tikus Wistar (40 lelaki/52 wanita) menerima dos ashwagandha oral sebanyak 500-2000 mg/kg berat badan (meliputi tempoh pra-kehamilan dan laktasi):
Badan ibu bapaBerat, berat organ reproduktif, dan tahap hormon tiroid menunjukkan tiada perbezaan dari kumpulan kawalan (tiada keabnormalan bergantung kepada dos).
Saiz sampah anjing, kadar kelangsungan hidup, dan berat badan dipadankan kumpulan kawalan; Tiada kecacatan luaran atau patologi telah dilihat.
Pada dos tertinggi (berat badan 2000 mg/kg), kadar kehamilan ibu bapa menurun sedikit (tiada makna toksikologi yang ketara), dan tiada patologi organ pembiakan dijumpai.
Kesimpulan: Ashwagandha tidak mempunyai kesan buruk terhadap fungsi pembiakan ibu bapa atau pertumbuhan/perkembangan anak.
Menggabungkan hasil dalam vitro dan vivo, keselamatan ekstrak ashwagandha disahkan sepenuhnya: sama ada digunakan jangka pendek, jangka panjang (90 hari), atau dalam konteks pembiakan/perkembangan, ia menunjukkan tiada ketoksikan yang ketara-walaupun pada dos yang jauh lebih tinggi daripada cadangan harian manusia biasa (tidak lebih daripada 100 mg/kg setiap pengambilan tunggal, atau ~ 21g setiap hari).
Kesimpulan ini menyediakan asas keselamatan yang boleh dipercayai untuk penggunaan ashwagandha dalam makanan berfungsi, makanan tambahan, dan produk yang sama.
Sebagai pembekal khusus dengan 20 tahun pengalaman dalam bahan mentah pemakanan (diasaskan pada tahun 2005), ekstrak ashwagandha bidang semulajadi adalah produk teras yang dibangunkan dan dihasilkan untuk piawaian keselamatan yang ketat ini. Kami bukan sahaja mengeluarkan kertas putih Ashwagandha pada tahun 2025 (secara sistematik menganjurkan data keselamatan dan keberkesanannya) tetapi juga mematuhi prinsip "menghasilkan bahan pemakanan dengan piawaian gred farmaseutikal." disokong oleh pasukan R & D profesional 32 orang, 39 paten kebangsaan, dan hampir 10 pensijilan domestik/antarabangsa (termasuk FSSC 22000 dan ISO), Kami memastikan kesucian dan kestabilan setiap kumpulan ekstrak ashwagandha.
Hari ini, produk ashwagandha kami melayani jenama terkemuka global seperti Nestle dan LG, mencapai 86 negara dan wilayah. Dengan gudang strategik di amerika syarikat, UK, dan banyak lagi, kami menyampaikan rantaian bekalan yang stabil dan cekap. Jika anda memerlukan bahan mentah ashwagandha yang mematuhi tinggi atau penyelesaian perumusan pemakanan yang disesuaikan, menjangkau sokongan teknikal pakar bidang as dan perkhidmatan yang fleksibel akan membantu membawa produk kesihatan anda ke pasaran.