Kemerosotan karbohidrat kompleks dan macromolecules lain oleh bakteria usus manusia menjana metabolites yang jiran mikrob menggunakan pernafasan anaerobik. Walau bagaimanapun, ia masih tidak jelas sama ada cross-feeding sebatian pemakanan lain dalam usus boleh memandu reaksi redoks menghasilkan tenaga.
Pada 4 ogos 2025, penyelidik dari universiti Yale menerbitkan satu kajian yang bertajuk "Metabolic cross-feeding antioksidan pemakanan meningkatkan metabolisme tenaga anaerobik oleh bakteria usus manusia" dalam sel tuan rumah & mikrob, jurnal kecil sel.
Kajian ini mendedahkan bahawa makan silang metabolik ergothioneine antioksidan pemakanan meningkatkan metabolisme tenaga anaerobik dalam bakteria usus manusia.

Dalam kajian terobosan ini, pasukan penyelidikan menunjukkan bahawa bakteria usus dari pertukaran phyla yang berbeza antioksidan pemakanan biasa di bawah keadaan anaerobik untuk menjana tenaga. Bakteria simbiosis Clostridium symbiosum encodes enzim ergothioneinase yang menukarkan ergothioneine (antioksidan yang berasal dari cendawan) ke dalam asid thiourocanic penerima elektron (TUA). Xylan-merendah-rendahkan bakteria Bacteroides xylanisovens kemudian mengurangkan TUA, ketara meningkatkan sintesis ATP dan menggalakkan pertumbuhan bakteria. Selain itu, TUA selektif dihasilkan dan dimakan oleh komuniti mikrob tahi manusia tertentu.
Selaras dengan persatuan yang baru ditemui antara ergothioneine homeostasis usus dan kanser kolorektal, gen ergothioneinase didapati diperkaya dengan ketara dalam metagenomes tahi dari pesakit kanser kolorektal.
Penemuan kolektif ini mendedahkan bagaimana pemakanan silang nutrien antioksidan simbiosis meningkatkan metabolisme tenaga mikrob, berpotensi menjelaskan perbezaan interindividual dalam risiko penyakit. Khusus:
C. Simbiosis ergothioneinase mengubah pemakanan ergothioneine ke TUA;
B. Xylanisovens menggunakan TUA sebagai penerima elektron, meningkatkan pengeluaran ATP sebanyak 2.3 kali ganda berbanding dengan kawalan;
TUA dinamik menunjukkan corak pengeluaran/penggunaan terpilih di seluruh manusia microbiomes.
Terutamanya, paksi metabolik ergothioneine-TUA adalah amat aktif dalam pesakit CRC, dengan gen ergothioneinase banyak correlating dengan perkembangan penyakit (p<0.01). Mekanisme cross-feeding berasaskan redoks ini mewakili pautan novel antara antioksidan pemakanan, ekologi mikrob usus dan kecenderungan kanser.
Symbiosum Clostridium metabolizes ergothioneine (EGT) ke dalam asid thiourocanic (TUA);
TUA boleh digunakan oleh Bacteroides xylanisolate untuk meningkatkan pertumbuhan anaerobik dan sintesis ATP;
Komuniti mikrob tahi manusia boleh menukar EGT untuk mengurangkan TUA melalui metabolik cross-feeding;
Gen yang bertanggungjawab untuk pengeluaran TUA diperkaya dalam metagenomes tahi pesakit kanser kolorektal.
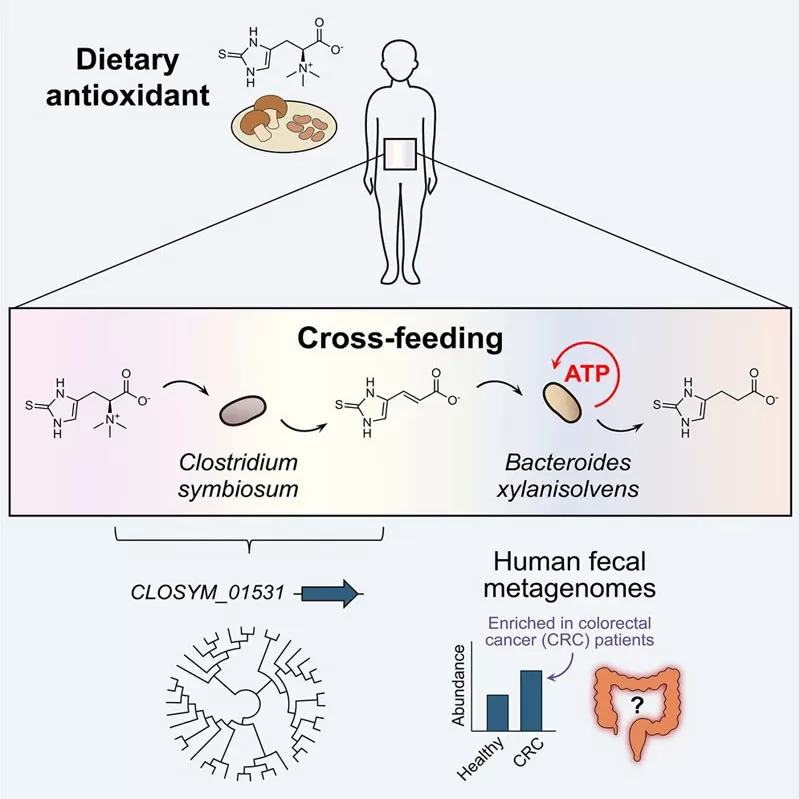
Secara kolektif, keputusan ini menunjukkan bahawa simbiosis cross-feeding nutrien antioksidan meningkatkan metabolisme tenaga mikrob-satu mekanisme yang boleh menjelaskan kepelbagaian interindividual dalam kecenderungan risiko penyakit.
Pautan kertas: https://www.cell.com/cell-host-microbe/fulltext/S1931-3128(25)00280-X